新闻资讯 了解首宏动态、掌握行业资讯
需求。巨大的市场潜力和多方的政策支持,推动了我国医疗设备外贸代理行业由小到大的快速增长,产品品类不断
提升,创新能力增强,部分细分行业龙头企业。
不可忽视的是,我国医疗器械外贸代理小、多、散和低水平竞争的现象尚没有得到根本转变,加速技术创新能力、
加强科学监管是当务之急。
信号一:创新产品审评审批将加快
会议明确,2022年要全面实施医疗器械审评审批电子化,加快创新产品审评审批;开展医疗器械“线上清网线下规范
”治理,加大对疫情防控医疗器械抽检力度。
国家药品监督管理局党组成员、副局长徐景和指出,当前,我国医疗器械行业进入“黄金发展期”,审评制度和审批
改革创新已进入“深度推进期”,监管能力建设进入“全面加强期”。监管进入“高风险期”。
徐景和对医疗器械监管提出五点要求:深入调查,整改隐患;继续加强对防疫队伍的监管;继续深化审批制度改革;
全面推进风险管理责任落实,千方百计加强基础设施建设。
会议明确,2022年全力支持医疗器械产业高质量创新发展。加快创新产品审评审批,促进科技成果转化应用,落实国
家重大战略,支持重点地区产业发展。
国务院办公厅去年9月下发的《“十四五”全民医疗保障规划》号(以下简称《医疗保障规划》号)提出,要提高药品
供应安全。深化审评审批制度改革,鼓励创新药物开发,加快新药好药上市,促进群众急需的新药、医疗器械开发和
使用。
国家食品药品监督管理总局在2021年医疗器械报告中指出,2021年国家食品药品监督管理局将继续按照《创新医疗器
械特别审查程序》 《医疗器械优先审批程序》审查相关产品,共受理医疗器械创新专项审批申请249件,同比增长比
2020年增长26.4%,其中获批进入专项审评程序62件,受理优先申请41件,比2020年增长46.3%,其中获批优先审批
14件。
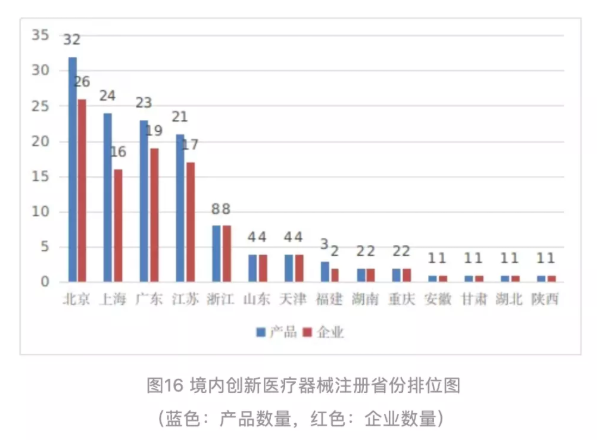
北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的134个创新医疗器
械的81%。
信号二:全面落实注册人制度
继续加强医疗器械基本注册能力建设。继续实施标准完善计划,不断完善医疗器械标准体系,加强分类命名和编码工
作,加强法规的宣传贯彻,大力开展监管科学研究,加强国际交流和合作。
不断提高医疗器械注册管理水平。规范地方注册备案业务,完善审批机制,完善国家办器械审评中心管理,加强临床试
验机构和试验项目管理,严厉惩治违法违规行为。
编码工作是管理医疗器械行业的关键工作。医疗器械编码对该行业的许多方面产生了深远的影响。据赛博蓝观察,首批
15家医疗器械唯一标识示范单位上线,包括注册商、生产企业和运营商。形成了以点为先、以区扩区的全国格局。
信号三:开展风险隐患排查整治
持续加强疫情防控医疗器械监管。加强对疫情防控医疗器械生产和经营使用环节监管,加大对疫情防控医疗器械抽检力
度。
不断加强监督检查检验和监测评价。持续开展飞行检查,强化质量监督抽检,加强不良事件监测。持续加大违法案件查
处力度,严惩重处医疗器械违法违规行为。
持续加强监管能力建设。完善医疗器械法规体系,加强法规宣传培训,强化检查员队伍和信息系统建设,加强监管科学
研究,推进社会共治。
免责声明:带有本公司标识的图片未经授权转载,将追究法律责任;文章部分文字、图片,视频提及来源于网络,如有侵权,请联系删除,版权归原作者所有。

首宏医疗控股集团股份有限公司 地址:山东省青岛市南区南京路8号府都大厦 16、20-22 层 联系电话:400-699-8388
Copyright @ 2018 Safehigh ALL Right Reserved.
ICP备案:京ICP证000000号